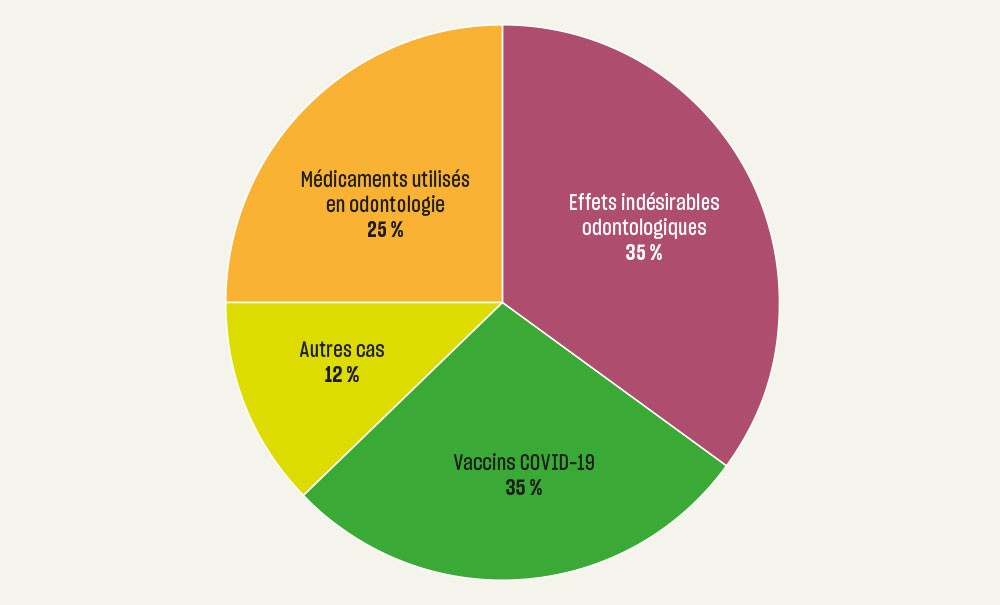
Quelques rappels sur la pharmacovigilance et sa réglementation
Conformément au Code de la santé publique (CSP), la pharmacovigilance a pour objet la surveillance, l’évaluation, la prévention et la gestion du risque d’effet indésirable résultant de l’utilisation des médicaments et produits à finalité sanitaire à usage humain, mentionnés aux articles L5121-1 [1] et R5121-150 [2] du CSP. En France, les Centres régionaux de pharmacovigilance (CRPV), au nombre de 30, sont indépendants de l’industrie pharmaceutique et répartis sur le territoire national pour favoriser les échanges de proximité avec les professionnels de santé et les patients. Chaque année, environ 45 000 effets indésirables sont recueillis par ces centres [3].
Les chirurgiens-dentistes font partie des professionnels de santé ayant l’obligation réglementaire de déclarer immédiatement tout effet indésirable grave suspecté d’être lié à un médicament, au même titre que les médecins, pharmaciens et sages-femmes. Selon les bonnes pratiques de pharmacovigilance, les chirurgiens-dentistes doivent déclarer « tout effet indésirable suspecté d’être lié à l’utilisation d’un ou plusieurs médicaments, qu’il soit grave ou non, listé ou non dans le résumé des caractéristiques du produit (RCP) et la notice patient, survenant dans des conditions d’utilisation conforme ou non conforme aux termes de l’autorisation ou de l’enregistrement du ou des médicaments ». Cette déclaration concerne également les effets indésirables résultant d’un surdosage, d’un mésusage, d’un abus, d’une erreur médicamenteuse, d’une interaction médicamenteuse, d’un défaut de qualité, d’une exposition pendant la grossesse, d’une exposition paternelle et d’une exposition pendant l’allaitement [4]. Selon son Code de déontologie, en lien avec le Code de la santé publique (article R4127-238), « le chirurgien-dentiste est libre de ses prescriptions…