On trouve l’oxyde de zirconium (Zr 02) à l’état naturel sous forme de minerai rare appelé Baddeleyite (fig. 1), dont les principaux gisements sont situés en Afrique du Sud. Cette source est cependant trop faible pour satisfaire à une demande de production industrielle. C’est en revanche le sable zirconifère d’Australie, constitué de 67 % de silicate de zirconium, qui permet de répondre à cette demande.
L’utilisation de la zircone à l’état naturel se limite sous forme de poudre abrasive ou d’additif de renfort, car elle se fissure. Son système cristallin est monoclinique. Le premier minerai a été découvert par Joseph Baddeley au Sri Lanka en 1892.
Les différentes structures cristallographiques de la zircone
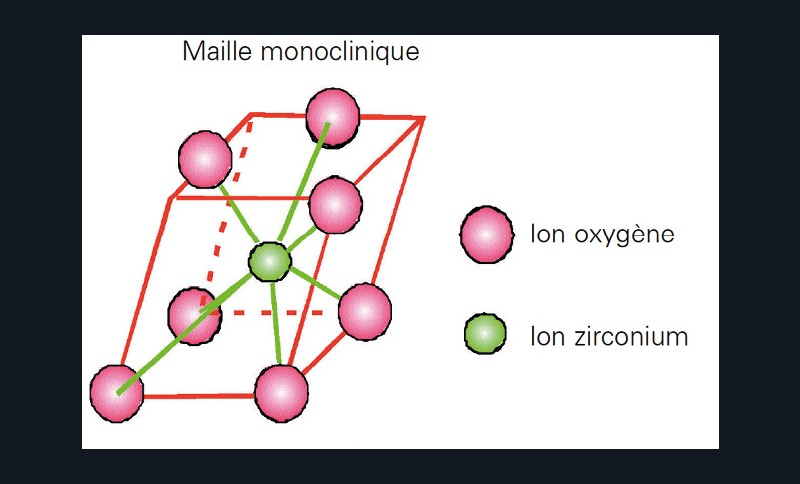
Ses différentes structures allotropiques la rendent instable, c’est pourquoi il est nécessaire de la stabiliser artificiellement. De la température ambiante jusqu’à 1 170°C, sa structure est organisée sous forme de mailles monocliniques (fig. 2) et ne présente aucune propriété mécanique intéressante.
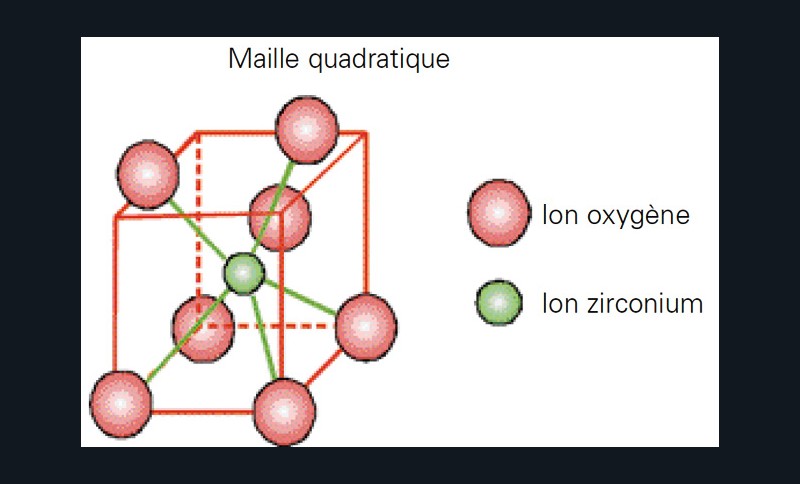
De 1 170°C à 2 370°C, sa structure se transforme en phase quadratique, dite également « tétragonale » (fig. 3), et présente sous cette forme toutes les propriétés mécaniques recherchées de la zircone.
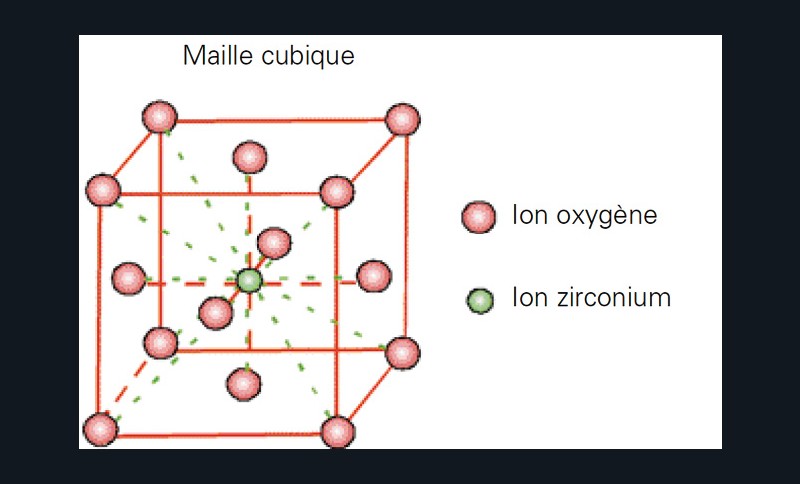
Au-dessus de 2 370°C, la structure passe en phase cubique (fig. 4), n’offrant à nouveau plus aucun intérêt quand à ses propriétés mécaniques.
Lors de son refroidissement, le phénomène s’inverse : de la phase quadratique, en descendant sous 950°C, elle retrouve sa phase monoclinique et perd ses propriétés mécaniques recherchées.
Il convient donc de forcer la structure à maintenir artificiellement sa maille quadratique en dessous de 950°C, afin de conserver toutes ses propriétés mécaniques. Ce phénomène est obtenu grâce à l’apport d’oxydes qui vont agir sur la quasi-totalité…