La présence de bactéries dans le canal, puis au sein du périapex, active les mécanismes de défense de l’hôte [18]. Il en résulte une réaction inflammatoire générant un recrutement des cellules de défense contre les micro-organismes intra-canalaires. Ainsi, la nature de la flore microbienne endodontique incriminée, la nature de la parondontite apicale et éventuellement de l’infection associée, ainsi que les modalités de colonisation de l’endodonte sont des éléments à considérer, car ils conditionnent pour une grande part la stratégie thérapeutique à mettre en place et surtout le pronostic de guérison. Une connaissance microbienne approfondie se révèle donc utile à la réalisation d’un traitement endodontique de qualité répondant aux données acquises de la science. Si la qualité de la préparation canalaire en elle-même est d’une importance capitale, elle devra être associée en amont à l’étude du type de pathologie apicale et à la considération de la flore microbienne présente.
La formation d’une LIPOE nécessite des conditions locales particulières [33] :
– une quantité suffisante de micro-organismes pathogènes pour initier et maintenir l’infection périradiculaire ;
– l’expression d’un ensemble de facteurs de virulence par les micro-organismes lors de l’infection radiculaire ;
– une localisation spatiale des micro-organismes au sein du canal permettant aux facteurs de virulence d’accéder aux tissus péri-radiculaires ;
– un environnement canalaire qui permettra la survie et la croissance des micro-organismes et de fournir des signaux de stimulation aux gènes de virulence ;
– l’absence ou la présence en trop faible quantité au sein de l’environnement canalaire d’inhibiteurs des micro-organismes ;
– la réponse de l’hôte par la mise en place d’une stratégie de défense au niveau périradiculaire associée à la circonscription de l’infection au sein du canal, générant des pertes tissulaires apicales.
La réunion de ces différentes conditions permettra l’initiation ou l’entretien d’une parodontite apicale.
Classification des parodontites apicales
Les parodontites apicales péri-radiculaires se distinguent en fonction des manifestations cliniques aiguës (parodontite apicale aiguë) ou chroniques (parodontite apicale chronique) qui leur sont associées, mais également en fonction des observations radiologiques et histopathologiques.
Les définitions suivantes sont issues du dictionnaire francophone des termes d’Odontologie Conservatrice de 2010 [4].
La parodontite apicale aiguë (PAA) correspond à une inflammation aiguë des tissus péri-apicaux. Elle peut être soit primaire, lorsqu’il s’agit d’une inflammation de courte durée, initiée dans un périapex sain, soit secondaire dans le cas d’une exacerbation aiguë d’une lésion chronique. En l’absence de traitement ou d’une réponse appropriée de l’hôte, si le système de défense est débordé et si l’origine de l’inflammation est bactérienne, la lésion peut évoluer vers l’abcès. On parle alors d’abcès phœnix ou récurrent.
La parodontite apicale chronique (PAC) correspond à une inflammation évoluant sur une longue durée, caractérisée par la présence d’un tissu de granulation majoritairement infiltré par des lymphocytes, plasmocytes et macrophages (granulome). Cette lésion, lorsqu’elle est épithélialisée, peut se transformer en kyste. Seule une analyse anatomo-pathologique peut différencier une lésion kystique d’une lésion granulomateuse.
Le kyste apical est un kyste inflammatoire constitué d’une poche à contenu le plus souvent liquidien, délimitée par une membrane épithéliale. On distingue les kystes vrais et les poches kystiques (ou kyste en baie) selon que le contenu du kyste est respectivement isolé du canal ou en continuité avec la lumière canalaire.
L’expression de ces pathologies péri-apicales est généralement liée à la présence, au sein du canal, de colonies microbiennes spécifiques : on parle alors d’infections intra-radiculaires.
Infections intra-radiculaires
Le diagnostic endodontique revêt une importance majeure et doit, dans la mesure du possible, conditionner l’acte endodontique afin de l’adapter au mieux à la situation clinique. En effet, différents moments de contamination de l’endodonte par les micro-organismes sont distingués.
Ainsi, lors d’une infection primaire, on retrouve en moyenne une vingtaine d’espèces microbiennes par canal [28], majoritairement représentées par des bactéries anaérobies, particulièrement des espèces Gram négatif appartenant aux genres Campylobacter, Dialister, Fusobacterium, Porphyromonas, Prevotella, Tannarella et Treponema. Des anaérobies Gram positif des genres Eubacterium, Peptostreptococcus et Pseudorambilater ainsi que des streptocoques facultatifs ou micro-aérophiles peuvent aussi être retrouvés dans les infections primaires ou initiales [29].
Quant aux infections secondaires, les micro-organismes retrouvés n’étant pas présents initialement, cela signifie qu’ils ont donc été introduits dans l’endodonte au cours de l’acte endodontique, en raison d’un éventuel défaut d’asepsie peropératoire. Une colonisation au cours de l’interséance, du fait d’un déficit d’étanchéité de l’obturation coronaire temporaire, est aussi envisageable. Les espèces principalement incriminées sont Gram positif comme les staphylocoques et surtout Enterococcus faecalis ; sont également observées des espèces Gram négatif comme Pseudomonas aeruginosa ou encore des variétés de Candida [29].
Dès lors, on comprend bien l’importance de respecter certaines précautions d’usage afin d’éviter l’introduction de ces espèces microbiennes au sein de l’endodonte :
– élimination de la plaque dentaire et du tartre avant la réalisation de la cavité d’accès endodontique ;
– élimination de tous les tissus carieux et de toute éventuelle ancienne restauration avant ouverture de la chambre pulpaire ;
– pose d’un champ opératoire étanche avant trépanation associée à une reconstitution coronaire préendodontique permettant l’obtention d’une cavité d’accès à quatre parois si nécessaire ;
– instrumentation stérile ;
– emploi de solutions d’irrigations éprouvées, non contaminées ;
– utilisation de pointes de papier stériles ;
– désinfection des cônes de gutta-percha avant leur insertion dans le canal puis stockage desdits cônes dans de l’hypochlorite de sodium jusqu’à obturation ;
– restauration coronaire temporaire étanche ;
– en présence d’un écoulement purulent non jugulable, maintien de la dent ouverte au maximum 48 heures ;
– réalisation d’une restauration d’usage étanche ;
– vérification de l’occlusion évitant la survenue de micro-fractures potentiellement colonisables ;
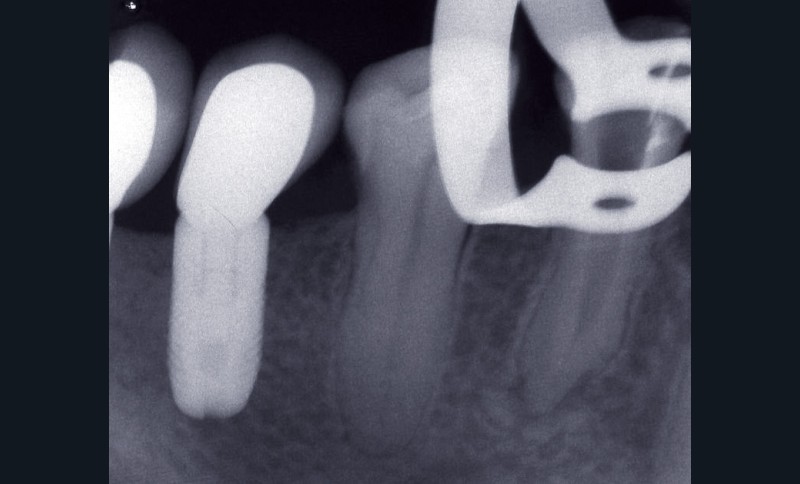
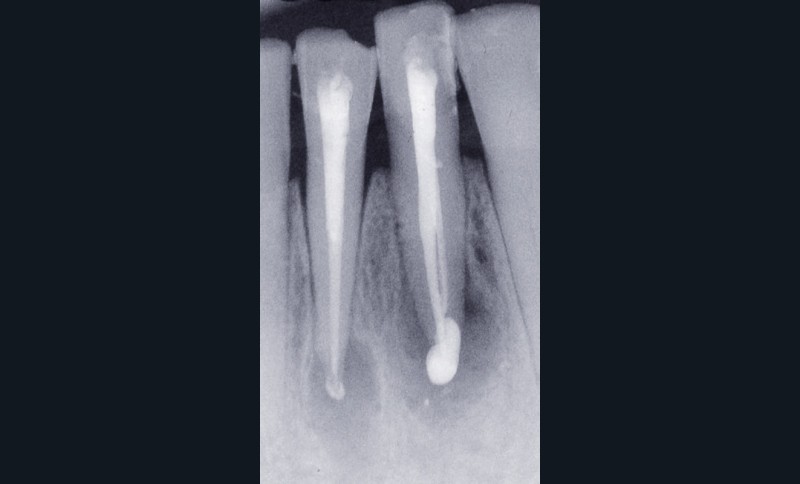
– obtention d’une étanchéité coronaire efficace le plus rapidement possible par le scellement d’un inlay-core et d’une couronne provisoire si les tissus dentaires résiduels sont insuffisants (fig. 1).
L’étanchéité des obturations coronaires provisoires et permanentes conditionne pour une grande part la réussite du traitement endodontique. Ainsi, en 1987, Swanson et Madison [42] ont montré qu’un traitement endodontique parfaitement réalisé était infiltré par des bactéries sur près de 85 % de sa hauteur entre 3 et 56 jours en l’absence de fermeture de la cavité d’accès endodontique. De la même manière, Torabinejad et coll. [44] ont étudié la pénétration de deux espèces bactériennes (Staphylococcus epidermis et Proteus vulgaris) au sein de canaux obturés par une technique de condensation latérale. Ils ont montré que dans plus de 50 % des canaux traités, les bactéries étaient retrouvées au niveau de l’apex 19 jours seulement après exposition à Staphylococcus epidermis et 42 jours après exposition de la cavité d’accès à Proteus vulgaris. Khayat et coll., en 1993 [12], ont montré qu’après 30 jours d’exposition à la salive naturelle, des bactéries étaient retrouvées au niveau apical pour l’ensemble des canaux traités.
En 1995, Ray et Trope [22] ont évalué radiographiquement sur près de 1 000 dents l’apparition ou non de lésions apicales selon les qualités de la restauration coronaire et de l’obturation canalaire. Les auteurs ont montré qu’un traitement endodontique de mauvaise qualité associé à une restauration coronaire de qualité donne de meilleurs résultats en termes de non-survenue d’une LIPOE qu’un traitement endodontique bien mené associé à une obturation coronaire défectueuse. Tavares et coll., en 2009 [43], confirment cette étude, en montrant que le taux de succès du traitement endodontique est plus élevé lorsque la restauration coronaire est de bonne qualité, et ce, indépendamment de la qualité du traitement endodontique.
Toutefois, la qualité d’une obturation coronaire, aussi bonne soit-elle, ne peut en aucun cas compenser un traitement endodontique de mauvaise qualité [45].
Infection extra-radiculaire
L’infection extra-radiculaire est caractérisée par une invasion microbienne des tissus péri-radiculaires enflammés. Cette infection est une séquelle de l’infection intra-radiculaire par dépassement de la barrière défensive. Elle peut être soit dépendante de l’infection intra-canalaire, comme c’est le cas dans les abcès apicaux aigus (AAA), soit indépendante, comme dans l’actinomycose apicale. Dans la première situation, le traitement endodontique complet par voie orthograde semble être suffisant, alors qu’une chirurgie apicale apparaît nécessaire pour obtenir la guérison lorsque l’infection est indépendante.
Principales manifestations cliniques
Les manifestations cliniques associées aux LIPOE sont d’une importance capitale dans l’établissement précis d’un diagnostic endodontique. Ainsi, l’association d’un interrogatoire médical et dentaire approfondi, d’un examen clinique et radiographique de qualité et de différents tests diagnostiques permet de définir plus précisément le type de pathologie existant.
La PAA primaire en réponse à une primo-infection bactérienne se manifeste par la mise en place d’une barrière de défense dont le rôle est de circonscrire l’infection à l’intérieur du canal. Dans sa phase débutante, la lésion n’est souvent pas visible radiographiquement mais, face à certaines espèces plus virulentes ou à un déficit des mécanismes de défense de l’hôte, l’infection peut se propager dans la région périradiculaire où elle sera plus clairement visible à la radiographie rétro-alvéolaire après quelques jours seulement.
La douleur est vive, spontanée, parfois continue et accentuée par la percussion. Les tests de vitalité pulpaire sont généralement négatifs. Toutefois, dans le cas d’une PAA débutante, certaines fibres nerveuses peuvent subsister, on parlera plutôt de pulpo-desmodontite.
Sans traitement adapté et en présence de bactéries pathogènes, la PAA peut évoluer vers l’abcès péri-apical, contre-indiquant dès lors le test à la percussion tellement celui-ci est insupportable. Les tissus mous environnants sont souvent œdématiés et la palpation est douloureuse.
La radiographie conventionnelle ne révèle pas forcément d’image radioclaire. Cependant, une radiographie 3D permet généralement d’objectiver, comme pour la PAA débutante, la présence d’une lésion apicale [13].
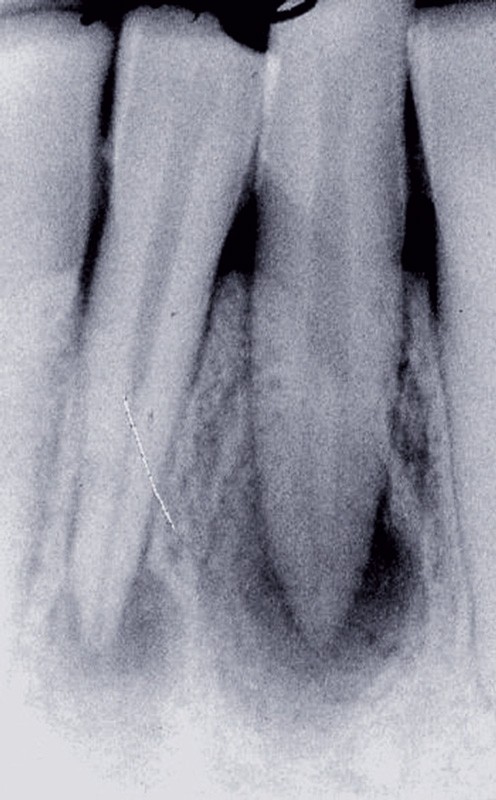
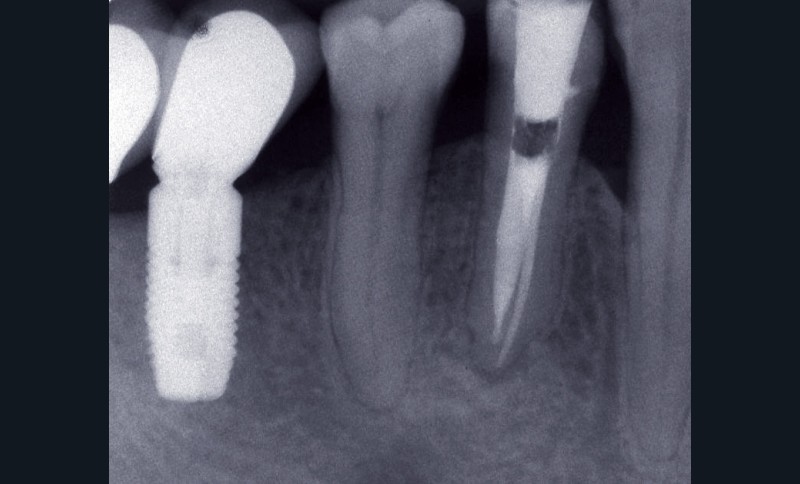
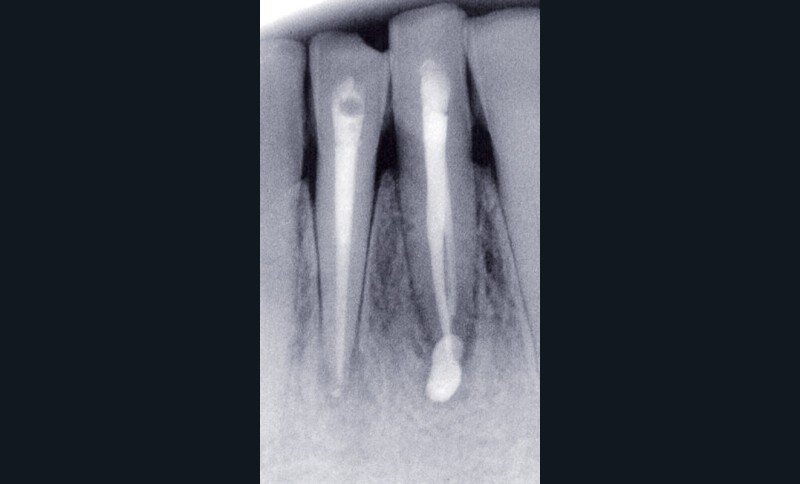
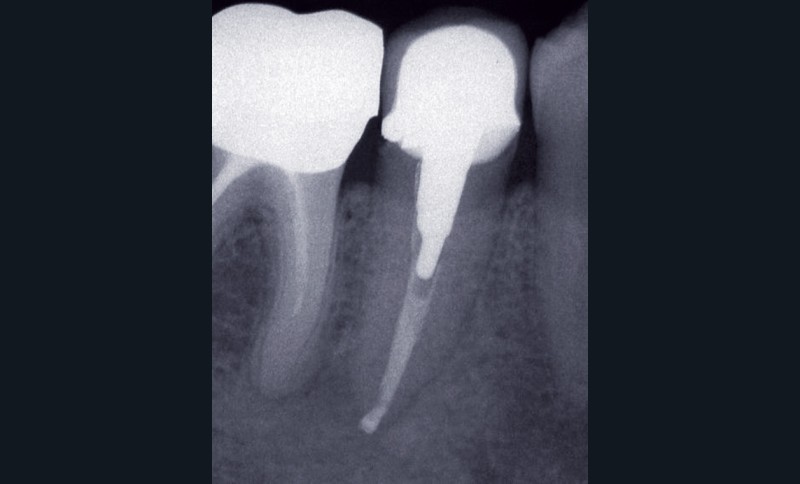
La PAC est fréquemment associée à un silence clinique, expliquant sa découverte généralement fortuite au cours d’une radiographie de contrôle (fig. 2).
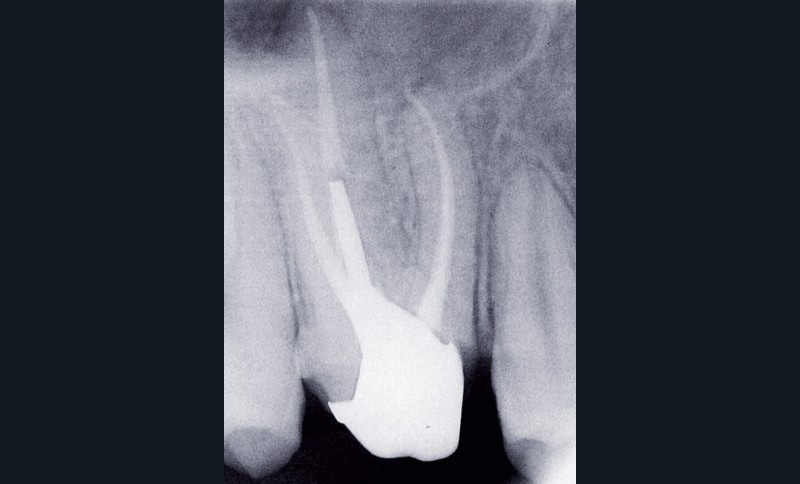
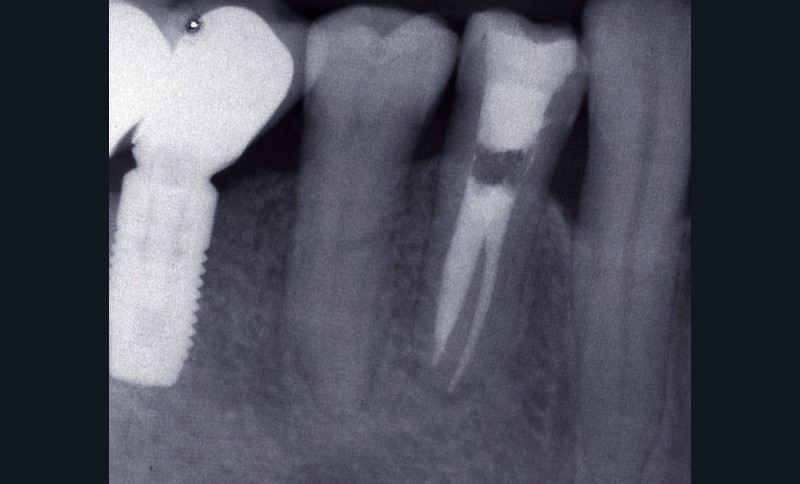
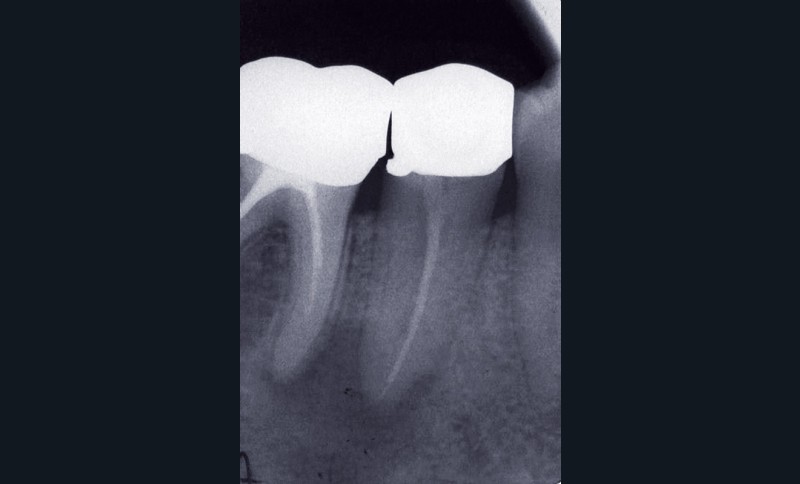
Dans certains cas, une douleur à la percussion et éventuellement à la palpation des tissus mous peut être rencontrée. L’image radiographique associée est celle d’une lésion granulomateuse ou d’un kyste. En l’absence de traitement approprié ou d’une diminution des défenses de l’hôte, la lésion peut s’exacerber sous la forme d’un abcès phœnix. La dent devient douloureuse et sensible à la percussion, les tissus mous sont œdematiés et douloureux à la palpation. La présence d’une petite fistule peut parfois être objectivée cliniquement (fig. 3) [13].
La PAC peut perdurer durant de longues années et présenter des phases avec fistulisation durant lesquelles la dent ne présente généralement pas de symptomatologie. Une fermeture spontanée de l’ostium fistulaire entraîne parfois l’exacerbation aiguë sous la forme d’un abcès.
Persistance des parodontites apicales
Le traitement des LIPOE consiste en l’élimination ou en la réduction significative de la charge bactérienne présente initialement au sein du canal ainsi qu’en la prévention de la réinfection après obturation canalaire. La réussite du traitement endodontique s’objective par la disparition progressive de la LIPOE par régénération osseuse [41]. Cependant, après la réalisation d’un traitement endodontique ou d’un retraitement de qualité, une image radioclaire peut perdurer. Nair [19] décrit six situations cliniques pouvant expliquer la persistance d’une lésion apicale radioclaire asymptomatique après traitement endodontique.
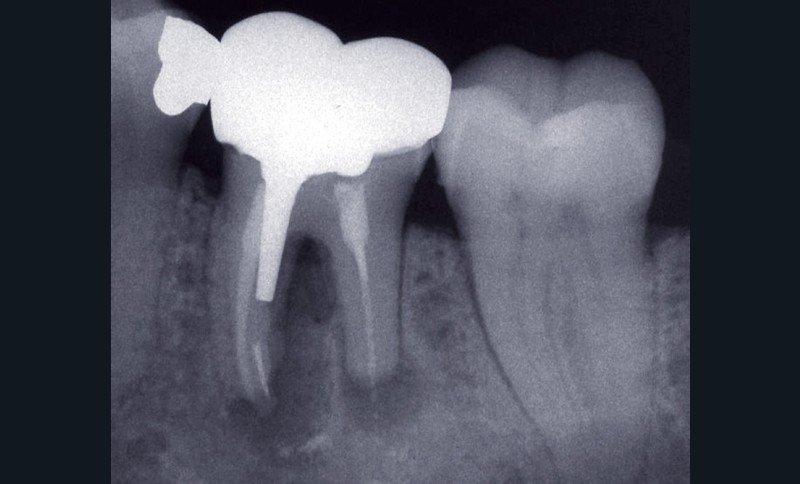
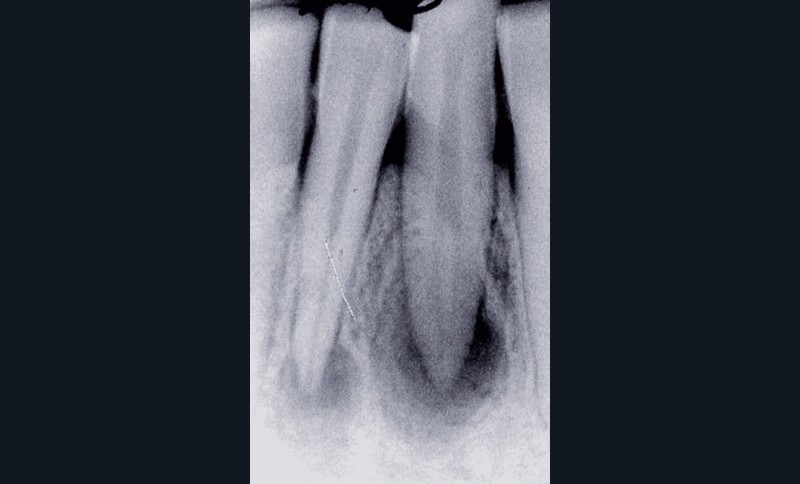
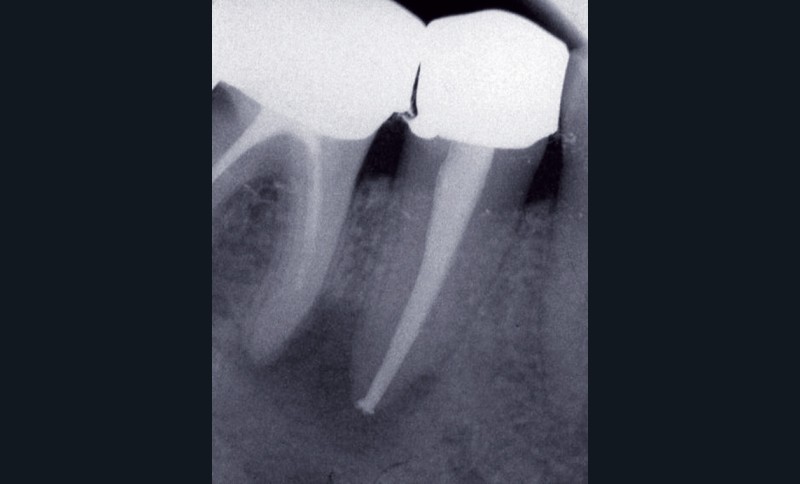
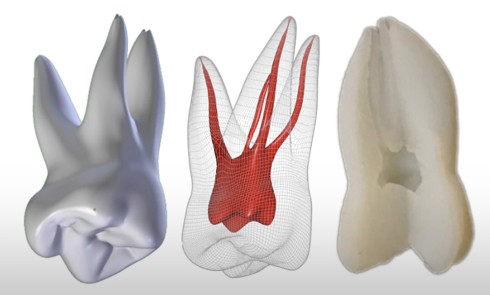
La première consiste en la persistance d’une infection intraradiculaire au sein de la zone apicale d’un canal riche en ramifications et en canaux accessoires ou d’un canal oublié (fig. 4) :
ces infections sont caractérisées par une flore microbienne particulièrement résistante correspondant aux micro- organismes résiduels à la suite d’une infection primaire ou secondaire. Ces micro-organismes sont généralement présents sous forme d’un biofilm au sein duquel ces derniers, noyés dans une matrice polysaccharidique adhérente aux parois canalaires [3], sont significativement plus résistants que ceux simplement en suspension [48]. Ils peuvent dès lors résister aux diverses solutions d’irrigation et médicaments intracanalaires, mais également survivre dans un environnement nutritionnel restreint [2, 5, 47]. Lors de la mise en forme canalaire, certaines régions, du fait de la complexité anatomique des racines, ne peuvent être ni débridées mécaniquement ni obturées. Ainsi, des colonies bactériennes sous forme de biofilm sont fréquemment retrouvées dans les ramifications apicales, dans les isthmes et au sein de concavités inaccessibles de la paroi radiculaire [19]. Ces zones représentent des niches de colonisation bactérienne pouvant par la suite contrarier la guérison apicale. Les micro-organismes retrouvés sont principalement Enterococcus faecalis et Candida albicans [41], même si d’autres espèces, plus généralement retrouvées dans les infections primaires comme Propionibacterium, ont été également mises en évidence [30, 32].
La deuxième situation concerne les infections extra-radiculaires persistantes sous forme d’actinomycose apicale. Cette dernière est une infection extra-radiculaire indépendante de l’infection intraradiculaire, ce qui sous-entend que le traitement endodontique orthograde à lui seul n’est pas suffisant pour obtenir une guérison de la lésion apicale. Les espèces retrouvées sont Actinomyces, principalement du genre israelii, et Propionibacterium propionicum [31, 34]. Les mécanismes de pathogénicité de ces espèces ne sont pas encore tout à fait élucidés. Il semble que ces bactéries aient la capacité d’élaborer des colonies bactériennes cohésives leur permettant d’échapper au système de défense de l’hôte [6], tant et si bien que même l’antibiothérapie systémique n’est pas efficace [34, 36]. Le recours à la chirurgie apicale après échec du traitement ou du retraitement endodontique est donc la seule option en vue de l’obtention de la guérison apicale. Fort heureusement, la prévalence d’actinomycose apicale est relativement faible [27].
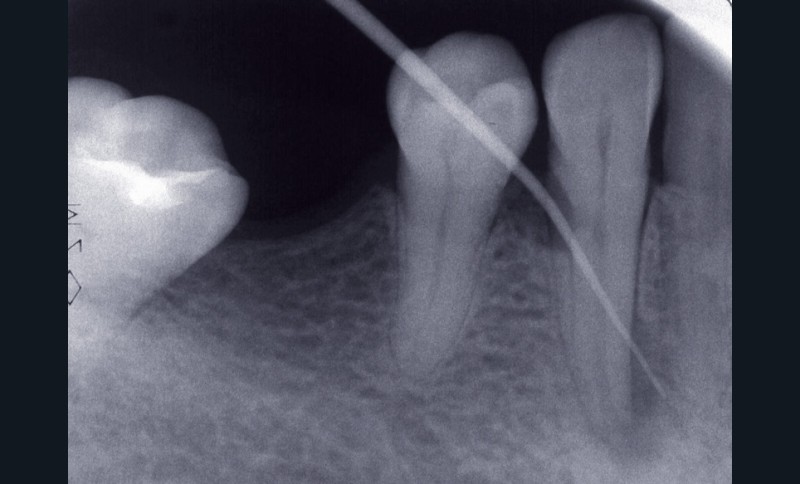
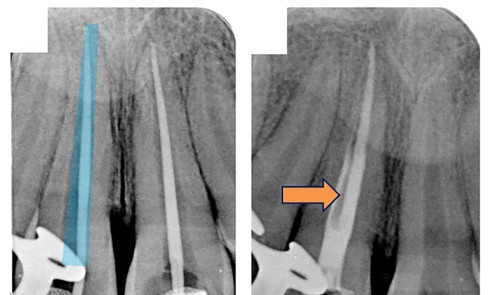
La troisième éventualité concerne le dépassement de matériau d’obturation canalaire (fig. 5) ou d’autres corps étrangers provoquant une réaction immunogène.
La présence d’éléments étrangers piégés dans le périapex au cours du traitement endodontique peut entretenir la lésion alors appelée granulome à corps étranger. Ainsi, même biocompatibles, des matériaux comme la gutta percha peuvent retarder la cicatrisation apicale [16], et ce d’autant si le cône de gutta percha ne présente pas toutes les garanties d’asepsie préalable ou s’il est contaminé par la présence de talc ou de poudre de latex provenant des gants. Sjögren et coll. [38] décrivent deux cas de figure. Si les éléments extrudés de gutta percha sont volumineux, ils seront encapsulés par une membrane collagénique. A contrario, si les particules sont fines, situation plus défavorable, elles induisent une réponse localisée intense, caractérisée par la présence de macrophages et de cellules géantes multinucléées à l’origine même de l’initiation de la lésion apicale. D’autres éléments néfastes à la guérison apicale peuvent être retrouvés. Ainsi, des particules végétales d’origine alimentaire peuvent être introduites dans le système endocanalaire si celui-ci est en contact avec la cavité buccale comme cela peut être le cas lors d’un traumatisme important ou d’une dent laissée ouverte. D’autres éléments extrinsèques peuvent être importés au cours de la préparation ou de l’obturation canalaire, comme des particules d’amalgame, de résine composite ou d’obturation temporaire. D’autres particules, par exemple les fibres de cellulose piégées lors du séchage canalaire à l’aide de pointes de papier ou issues des cotons éventuellement employés en interséance, peuvent contrarier la cicatrisation. Ces éléments sont en effet difficilement dégradés par les cellules de défense de l’hôte et peuvent même favoriser la croissance de biofilms bactériens à leur surface.
La quatrième éventualité est l’accumulation de cristaux de cholestérol endogènes irritant les tissus péri-apicaux. La présence de ces cristaux peut même, selon une étude de Nair [17], maintenir la LIPOE indéfiniment. Plusieurs théories sont aujourd’hui avancées pour expliquer la présence de ces cristaux. L’une d’elles, communément acceptée, correspond à la cristallisation des lipides libérés à la suite de la désintégration d’érythrocytes ou de cellules inflammatoires de type lymphocytaire et des lipides circulants [17]. Les macrophages et autres cellules géantes présentes autour des cristaux n’ont en effet pas la capacité de dégrader ces derniers et sont à l’origine de la libération de médiateurs de l’inflammation et de résorption osseuse [37].
La présence d’une vraie lésion kystique est une autre éventualité clinique expliquant la persistance de LIPOE. Il faut, à ce titre, distinguer les kystes en baie, dont la guérison s’obtient généralement après la réalisation du traitement endodontique [26] des kystes vrais, totalement indépendants du système canalaire. Ces kystes « auto-suffisants » sont totalement bordés d’un épithélium continu, sans lien avec le canal radiculaire. Ils sont formés de divers débris nécrotiques, d’érythrocytes et parfois même de cristaux de cholestérol. Étant donné l’indépendance de cette lésion avec le canal radiculaire, le retraitement endodontique orthograde se révèle généralement voué à l’échec et le recours à la chirurgie apicale semble être de mise. Le diagnostic de ce type de lésion est impossible avec les moyens radiographiques et relève de l’examen anatomo-pathologique. Cependant, la prévalence des kystes vrais est relativement faible [14], expliquant le pourcentage important de réussite des (re-)traitements endodontiques sur les dents porteuses de LIPOE [20].
Enfin, la présence de tissus cicatriciels à la suite de la guérison de la lésion peut faire penser à une absence de guérison des tissus péri-apicaux à l’examen radiologique. Cependant, ces images peuvent en réalité simplement correspondre à des reliquats de tissus cicatriciels sans conséquence clinique [15]. La guérison apicale dépend d’une part du potentiel de régénération cellulaire et, d’autre part, de la vitesse avec laquelle les cellules bordant la lésion vont intervenir [11]. Ainsi, les précurseurs du tissu conjonctif peuvent coloniser les tissus péri-apicaux avant les cellules régénératrices, engendrant de ce fait la formation d’une cicatrice résiduelle.
Traitement en une ou plusieurs séances ?
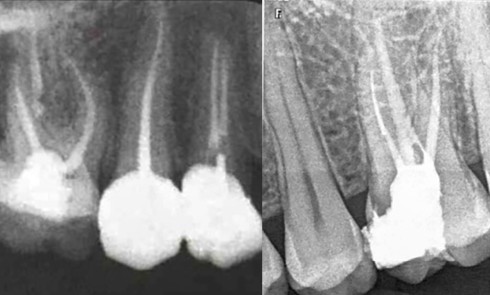
S’il est admis aujourd’hui qu’il est préférable de traiter endodontiquement les dents exemptes de lésions apicales en une seule séance [8], la question reste posée pour les dents affectées d’une LIPOE. Faut-il procéder de façon systématique à une phase de médication temporaire au cours du traitement endodontique des dents porteuses d’une lésion péri-apicale ? Certains auteurs [1, 35, 39] préconisent la mise en place d’une phase d’hydroxyde de calcium (CaOH2) afin d’obtenir un canal exempt de bactéries. À l’inverse, d’autres études [7, 24, 25, 40, 46] s’accordent sur le fait qu’il n’y a pas de différence significative entre le traitement en une ou plusieurs séances des dents porteuses d’une PAC, en termes tant de taux de guérison que de complications postopératoires (fig. 6).
En conséquence, d’autres critères de choix doivent être pris en compte.
La mise en place d’une phase de CaOH2 nécessite une réintervention, augmentant de ce fait le risque de contamination bactérienne du canal. De plus, le patient peut aussi, en raison de la diminution ou de l’absence de douleur à la suite de la préparation chimio-mécanique initiale, ne pas honorer le rendez-vous suivant. Or, l’hydroxyde de calcium n’est actif que sur une période relativement courte, au-delà de laquelle le canal pourra de nouveau être contaminé par des bactéries, compliquant donc encore d’avantage le pronostic de guérison. À cela s’ajoute la difficulté d’éliminer complètement l’ensemble du CaOH2 au sein du canal et la nécessité d’une réinstrumentation canalaire doublée d’une irrigation à l’aide d’un agent chélatant comme l’EDTA liquide (à 17 % environ) ou l’acide citrique (entre 10 % et 20 %). Même si le CaOH2 reste le matériau de choix, soit en interséances, soit face à une symptomatologie aiguë ou à l’impossibilité d’obtention de canaux secs, son action reste limitée et nécessite un contact direct avec les micro-organismes. Certains auteurs [10, 21] ont d’ailleurs mis en évidence la persistance de certaines espèces microbiennes, notamment Enterococcus faecalis, même après la mise en place d’une phase de CaOH2. D’autres espèces comme Candida albicans semblent également résister à l’action antimicrobienne du CaOH2. Pour d’autres encore, son action antibactérienne est plus faible que celle exercée par certains ciments d’obturation canalaire à base d’oxyde de zinc-eugénol [23].
Au vu de ces éléments, on peut donc conclure qu’il est préférable, si le temps dont dispose le praticien le permet, en l’absence de symptomatologie aiguë et en présence de canaux secs en fin de préparation, d’obturer la dent en une séance unique en respectant toutes les conditions d’asepsie et de mise en forme requises pour un traitement endodontique de qualité [9]. Un rinçage à l’hypochlorite de sodium à 2,5 % pour son action lubrifiante, antiseptique et solvante des débris organiques tout au long de la préparation canalaire, associé à une vérification de la perméabilité apicale à l’aide de limes de petits diamètres pour éliminer d’éventuels bouchons dentinaires, suivi d’un rinçage final à l’EDTA liquide ou à l’acide citrique, du fait de leur action solvante des débris minéraux, et enfin d’un séchage minutieux des canaux semble constituer un protocole efficace afin d’optimiser la guérison apicale. Une activation des différentes solutions d’irrigation, soit manuellement à l’aide d’un cône de gutta percha calibré, soit à l’aide d’accessoires dédiés (EndoActivator™, Irrisafe™, etc.) semble augmenter encore le pronostic de guérison. Enfin, la réalisation d’une obturation canalaire tridimensionnelle à la gutta percha associée à la recherche d’une étanchéité coronaire optimale se révèle aussi décisive à ce titre.
Conclusion
L’étiologie bactérienne des LIPOE est aujourd’hui bien établie. Toutefois, la présence de certaines conditions locales (micro-organismes pathogènes, réponse de l’hôte, expression des facteurs de virulence, environnement propice à la croissance des micro-organismes) est aussi nécessaire à l’apparition d’une lésion apicale.
L’élimination des bactéries présentes au sein du réseau canalaire par l’intermédiaire d’une préparation chimio-mécanique de qualité, puis l’obturation tridimensionnelle étanche de l’ensemble du système endodontique sont les prérequis nécessaires à l’évolution favorable d’une LIPOE.
De plus, la réalisation d’une obturation coronaire étanche et fonctionnelle est aussi un élément indispensable dans l’optimisation de la cicatrisation apicale.
Cependant, malgré la réalisation d’un traitement endodontique de qualité répondant à toutes les exigences requises, il arrive que certaines lésions restent réfractaires aux traitements endodontiques conventionnels. Dans ce cas, la chirurgie apicale se révèle nécessaire. Néanmoins, du fait de la difficulté rencontrée quant à la mise en évidence des facteurs d’échecs, le traitement ou le retraitement endodontique devra, dans la mesure du possible, être entrepris en première intention. La surveillance clinique et radiologique régulière guidera dès lors l’indication de chirurgie apicale.










Commentaires