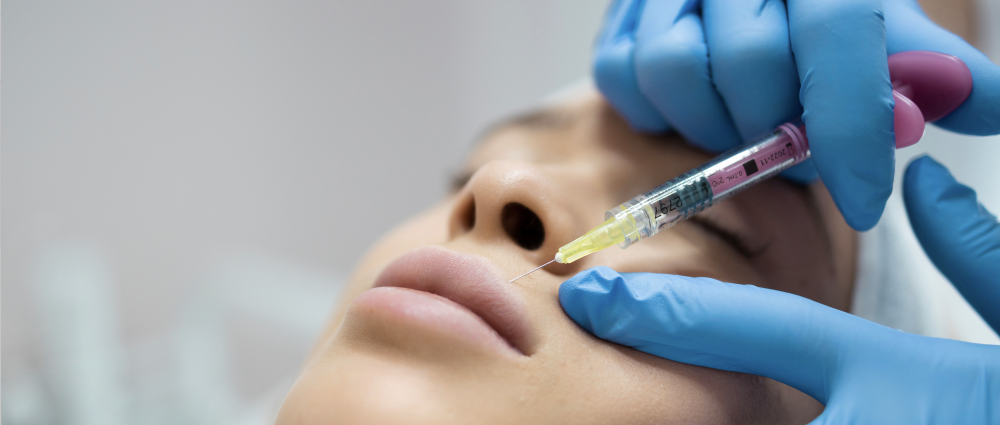
Face à la croissance rapide du marché, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a coordonné, avec neuf autres pays européens (Autriche, Allemagne, Belgique, Danemark, Finlande, Irlande, Lettonie, Norvège et Pologne), une action conjointe de contrôle de conformité et de sécurité « des produits injectables de comblement dermique à base d’acide hyaluronique », indique-t-elle le 21 janvier.
Conçus pour traiter les cicatrices, redonner du volume ou encore réduire l’apparence des rides et ridules, l’utilisation de ces produit « n’est pas sans risques, même lorsque ils sont conformes à la réglementation européenne, souligne l’ANSM qui rappelle à l’attention du grand public, qu’en France, depuis le 1er juillet 2024, « les dispositifs injectables contenant de l’acide hyaluronique ne peuvent être vendus qu’aux médecins et chirurgiens-dentistes et ne peuvent être délivrés par les pharmacies aux patients que sur prescription médicale. Seuls ces professionnels de santé sont autorisés à réaliser ce type d’injections. »
Pas de restriction en France
Les analyses de laboratoire ont porté sur la stérilité, la présence d’endotoxines, la cytotoxicité et d’éventuels composés chimiques nocifs. Treize produits sur dix-sept se sont révélés pleinement conformes aux exigences réglementaires. L’ensemble des échantillons a satisfait aux tests de stérilité.
En revanche, quatre produits ont présenté des anomalies ponctuelles, concernant la biocompatibilité, la composition ou la présence d’endotoxines, justifiant des investigations complémentaires avec les fabricants.
En France, deux produits ont été contrôlés. Pour l’un d’eux, les résultats ont conduit le fabricant à modifier son emballage. Le second s’est révélé conforme. « À ce stade, aucune des non-conformités constatées n’a justifié la mise en place de mesures de restriction », précise l’agence du médicament.
L’ANSM invite les praticiens à signaler tout effet indésirable via le portail officiel de déclaration.










Commentaires