Dans l’état actuel des connaissances, la contamination par le SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus-2) passe essentiellement par les muqueuses de la bouche, du nez, les yeux et via la bouche et le nez, par le tractus respiratoire bas. La transmission du virus peut se faire (Peng et coll., 2020):
– directement, par voie aérienne via des gouttelettes émises par toux, éternuement, élocution, rire, chant ou simple souffle respiratoire, d’un tiers porteur du virus vers un sujet proche ;
– par contact avec des surfaces souillées par le dépôt de gouttelettes ou bio-aérosols (on parle de fomites), ou par contact direct avec des mains chargées en virus d’un sujet puis portage viral des mains à leur tour souillées du susdit sujet vers ses muqueuses orales, nasales ou oculaires. Le contact peut aussi se faire par morsure, baisers ou relations sexuelles (sexualité orale).
Compte tenu du terrain qui concerne l’activité professionnelle du chirurgien-dentiste, la bouche, nous nous proposons de faire le point sur ce qui pourrait nous éclairer sur la nature de ces gouttelettes et bio-aérosols, leur mode d’émission, leur évolution, leur potentiel contaminant. Nous nous en tiendrons essentiellement aux gouttelettes émises dans les conditions énoncées ci-dessus, n’abordant que succinctement la problématique des projections liées aux soins de bouche peu documentée en ce qui concerne SARS-CoV-2 (Peng et coll., 2020 ; Sabino-Silva et coll., 2020).
Selon l’Institut national de recherche et de sécurité pour la prévention des accidents du travail et des maladies professionnelles (INRS, inrs.fr), la transmission est un mécanisme de passage d’un micro-organisme depuis un réservoir (sujet porteur) vers un hôte susceptible. Pour qu’une infection survienne, l’agent infectieux doit pénétrer dans l’organisme par une porte d’entrée spécifique, et ce en concentration suffisante (dose infectante). Le passage d’un micro-organisme nécessite un vecteur : le sang, des aliments, des gouttelettes et des aérosols (transmission dite aéroportée), la salive, des instruments de soin, des dispositifs médicaux… Un même micro-organisme peut être transmis par plusieurs voies.
De nombreux virus se transmettent par voie aérienne : HRSV (virus respiratoire syncytial), H1N1 (sous-type du virus A de la grippe), hantavirus, virus entérique, VZV (varicelle-zoster-virus), virus de la rougeole, des oreillons, de la rubéole, MERS et SARS-1 (Yu et coll, 2004), et aujourd’hui le SARS-CoV-2 (Van Domeralen et coll., 2020). Les infections respiratoires sont particulièrement concernées par ce mode de transmission (Garner, 1994 ; Yu et coll., 2004). Nous rappelons que ces transmissions aériennes concernent aussi le champ des infections nosocomiales.
La transmission aéroportée
La transmission aéroportée est un processus par lequel des gouttelettes se dispersent dans l’air depuis le nez ou la bouche d’un sujet infecté et à partir duquel d’autres sujets qui inhalent cet air peuvent être infectés (Yang et coll., 2007). Ce type de transmission repose sur des particules de diverses dimensions (≤ 100 µm) qui restent suspendues dans l’air pour des périodes plus ou moins longues.
Mais que sont ces gouttelettes ? Ce sont des petites particules aéroportées de tailles très variables (de moins de 1 µm à plusieurs centaines de µm), dont la composition reflète leur lieu d’origine. On distinguera les plus grosses d’entre elles, dont la masse est telle qu’elles retombent assez rapidement vers le bas, et les plus petites qui forment un bio-aérosol pouvant se répandre à plusieurs mètres de leur lieu d’émission et y séjourner quelques heures.
Il y a lieu de distinguer plusieurs circonstances de production des gouttelettes exhalées (Xie et coll., 2009) :
– la simple respiration, lors de la phase expiratoire (nasale et/ou buccale) ;
– l’élocution plus ou moins forte et ses variantes que sont le rire et le chant ;
– les situations particulières représentées par la toux et l’éternuement ;
– les projections inhérentes aux soins bucco-dentaires.
La nature, le déplacement, la forme et les tailles de ces gouttelettes ne seront pas les mêmes selon le type d’exhalation (telles que décrites ci-dessus), compte tenu des vitesses des flux d’air qui les propulsent et des territoires anatomiques puis atmosphériques traversés par ce flux.
La respiration/l’expiration
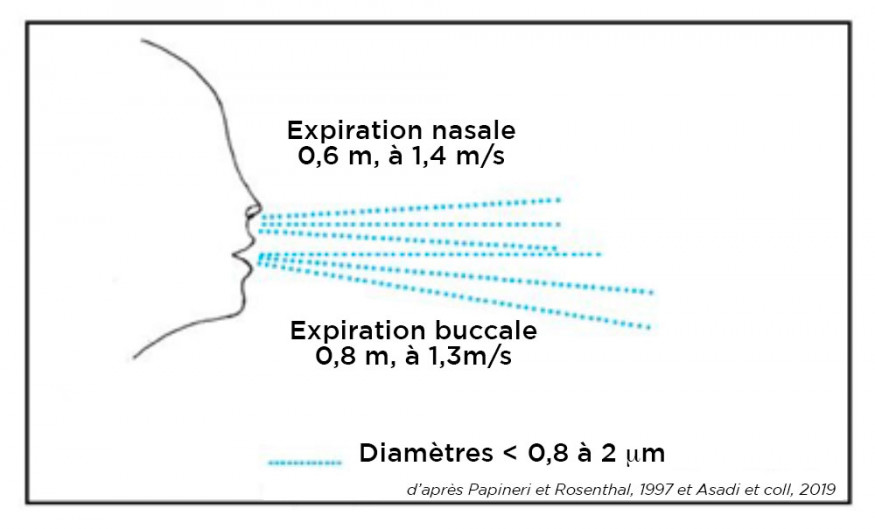
L’expiration normale (volume courant de l’ordre de 0,5 l par cycle, volume de réserve expiratoire d’environ 1 l) produit des gouttelettes selon un processus de condensation et d’atomisation à haute vitesse. Les gaz chauds (36°C) et humides (6,2% d’eau) de la région alvéolaire transitent des poumons vers les voies aériennes supérieures où ils se refroidissent jusqu’à atteindre un état liquide (point de rosée) avant d’être expulsés sous forme de gouttelettes par le flux d’air expiratoire (Gralton et coll., 2011). Lors d’une expiration respiratoire strictement nasale (territoire buccal non concerné), la distance maximale de propagation du flux d’air est de 0,6 m avec une vitesse initiale de 1,4 m/s. Pour une expiration cette fois, strictement buccale, la distance de propagation sera de 0,8 m et la vitesse initiale de 1,3 m/s (Tang et coll., 2013) (fig. 1). Les gouttelettes exhalées sont majoritairement très petites (< 0,8 µm), une minorité pouvant atteindre 2 µm (Papineri et Rosenthal, 1997). On peut considérer que ces gouttelettes sont essentiellement constituées d’eau, la part solide étant marginale, et donc l’éventuelle charge virale relativement faible.
Se pose la question des situations de respiration forcée, lors d’exercices physiques par exemple ; si le volume expiré par cycle est accru, c’est surtout la fréquence des cycles respiratoires qui augmente et donc, in fine, le débit ventilatoire (environ 6 l/min au repos, jusqu’à 100 l/min et plus dans l’effort). Il n’est pas avéré à ce jour que la nature des gouttelettes, et donc leur taille, et donc leur éventuelle charge infectante, soit profondément modifiée lors d’une respiration d’effort. En revanche, le volume d’air (et ses fines gouttelettes) expiré dans l’espace avoisinant est considérablement accru.
L’élocution
En termes de flux d’air, l’élocution se distingue de la respiration par la vibration des cordes vocales, les mouvements de la langue et des lèvres. Selon l’intensité de la voix, de la langue parlée, de particularités liées à chaque individu, on émet en parlant de 1 à 50 particules par seconde, ce qui représente 0,06 à 3 particules par cm3 (Asadi et coll., 2019). La proportion de gouttelettes sensiblement plus grosses (de l’ordre de 1 µm) que lors de la simple expiration, s’explique par l’incorporation d’un peu de salive, et donc d’éventuels virus. Le nombre de particules exhalées est proportionnel à la hauteur du verbe (Asadi et coll, 2019) et à l’articulation de certaines consonnes occlusives et fricatives.
Compte tenu de la relativement faible vitesse du flux d’air (1,3 à 1,4 m/s) et la distance moyenne de propagation (0,6 à 0,8 m), on comprend la pertinence des recommandations OMS de distanciation physique (1,5 m) !
Formation des gouttelettes lors de la toux et de l’éternuement
La toux et l’éternuement représentent une autre source d’émission de gouttelettes et de bio-aérosols. Notons que ces deux évènements sont des symptômes associés au Covid-19.
La toux et l’éternuement sont la conséquence d’une irritation, soit des cavités nasales, soit de la trachée, par accumulation excessive de mucus (conséquence d’une infection respiratoire) qui, normalement, pour les poumons, est évacué vers le haut par battement des cils à une vitesse de 4 à 20 mm/min. Rappelons que les mucus ont vocation à piéger les particules inhalées et les micro-organismes envahissant les voies respiratoires, ainsi que les débris cellulaires desquamés, mais aussi de protéger les muqueuses de la déshydratation. L’irritation provoque, par réflexe, une fermeture de la glotte ou du pharynx, retenant l’air en aval et générant des pressions intrapleurales et intralvéolaires très élevées (phase compressive). Cette phase est suivie d’une réouverture rapide (20 à 40 ms) soit de la glotte, soit du pharynx, avec expulsion brutale de l’air retenu (phase explosive de la toux et de l’éternuement) (Janssens, 2004).
La vitesse maximale du flux d’air produit par un éternuement est de 4,5 m/s et la propagation atteint plusieurs mètres (Tang et coll., 2013). Pour la toux, la vitesse initiale peut atteindre 10 m/s (femme) et 13,2 m/s (homme) (Chao et coll., 2009) et décroît jusqu’à 1,2 m/s à 0,72 m de la bouche (Yan et coll., 2019), avec un débit d’air de 5 à 8 l/s (Gupta et coll., 2009).
Ce flux d’air généré par les alvéoles pulmonaires entraîne du mucus du tractus respiratoire, mais aussi du fluide oral lors du transit buccal, ou du mucus nasal lors de l’éternuement. Il en résulte une composition complexe de l’éjecta post-toux ou éternuement (gouttelettes jusqu’à 100 µm). En plus de la vapeur d’eau et des différents mucus déjà évoqués, on retrouve tout ce qui a été piégé par les mucus à leurs niveaux respectifs, en particulier de nombreux micro-organismes (Fahy et Dickey, 2010). Mais n’oublions pas que ces mucus sont constitués d’eau à 97 % pour le poumon et 99,5% pour le fluide oral.
Intéressons-nous maintenant à la dynamique des gouttelettes émises lors de la toux et de l’éternuement. On assiste à un phénomène de fragmentation de l’éjecta post-éternuement (Scharfman et coll., 2016). Dès la sortie dans l’atmosphère, les gouttelettes assez grossières (jusqu’à 100 µm) ont tendance, en une vingtaine de millisecondes, à s’aplatir, puis des trous se forment, ce qui entraîne une déstabilisation de l’ensemble en filaments puis en gouttelettes sur 20 à 70 cm. Les plus grosses gouttelettes résiduelles, éventuellement chargées en éléments infectieux contaminants, retombent assez vite (0,8 à 1,5 m) vers les surfaces sous-jacentes (les fomites) du fait de leur masse, de leur inertie et de la perte de vitesse du flux d’air.
Dans ce court espace de 0 à 1,5 m et avant de retomber, ces grosses gouttelettes, dont la taille peut avoisiner 100 µm, sont susceptibles d’être inhalées par un tiers ; elles sont qualifiées de gouttelettes inspirables (10 à 100 µm) qui semblent interagir plus volontiers avec les surfaces du tractus respiratoire supérieur, bouche et nez (Gralton et coll., 2011 ; Stilianakis et coll., 2010). Il a été montré que les cellules de l’épithélium nasal co-expriment les deux récepteurs (ACE2 et TMPRSS2) qui permettent l’entrée du virus SARS-CoV-2 à l’intérieur de la cellule-hôte (Sungnak et coll., 2020). Certaines cellules de la muqueuse buccale (langue, canalicules des glandes salivaires…) qui expriment ACE2 et la furine (une enzyme facilitant la pénétration du virus dans la cellule hôte) pourraient aussi être des cellules hôtes pour le SARS-CoV-2 (Xu et coll., 2020 ; Lin et coll, 2020).
En revanche, le rapide flux d’air généré par la toux ou l’éternuement favorise la formation, par refragmentation, de plus petites particules de diamètre inférieur à 16 µm (Chao et coll., 2009) qui sont alors soumises à la chaleur et à l’humidité relative de l’air ou hygrométrie (rapport entre la teneur en vapeur d’eau d’un volume d’air donné et sa capacité maximale à en contenir, dans des conditions de température et de pression fixées = RH). Les gouttelettes essentiellement aqueuses (97 à plus de 99 % d’eau) et de faible charge en constituants non volatils perdent progressivement leur eau jusqu’à ce qu’il ne reste qu’un noyau essentiellement solide de diamètre ≤ 10 µm (Liu et coll., 2017). On parle alors de noyaux-gouttelettes. La dynamique de ce phénomène de dessiccation est complexe du fait de l’inhomogénéité de l’air entourant le sujet. Les modélisations mathématiques qui en ont été faites sont imparfaites (Li et coll., 2018) mais concluent à ce jour que l’évaporation se fait en 1 à 10 secondes pour les gouttelettes les plus grosses (10 à 100 µm) pour une humidité relative (RH) de 50%. Si l’atmosphère est inhomogène en termes d’humidité, les temps de trajectoire et la taille des particules résultantes en seront affectés (Morawska et coll., 2009). Plus l’air est sec (RH bas), plus le processus d’évaporation des gouttelettes sera rapide (Xie et coll., 2007). Ces noyaux-gouttelettes de très faible masse (≤ 10 µm) restent en suspension dans l’air (aéroportés) et sont qualifiés de respirables (ils peuvent pénétrer profondément l’arbre respiratoire de sujets avoisinants); ils constituent un bio-aérosol (fig. 2).
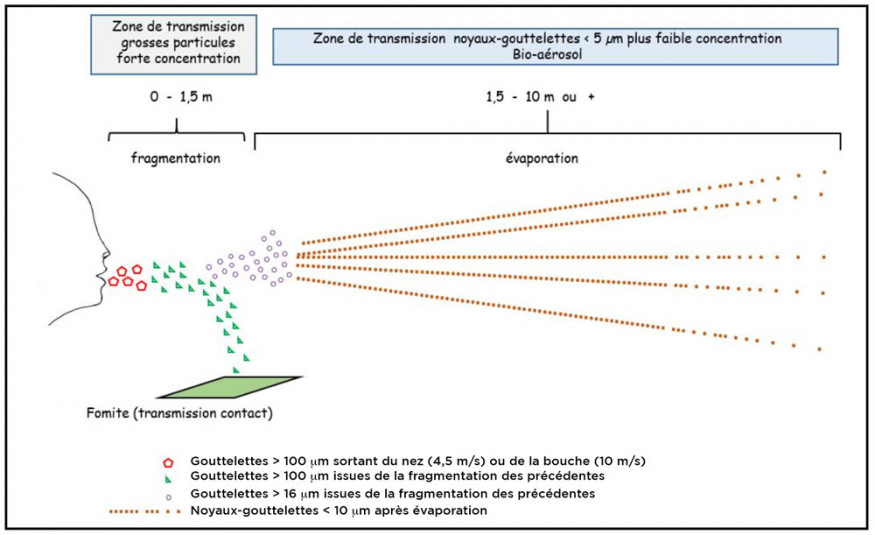
Ce bio-aérosol à fins noyaux-gouttelettes à concentration décroissante avec la distance de la source présente un risque infectieux potentiel à plusieurs mètres du sujet source (Li et coll., 2018), surtout dans des espaces confinés. La distanciation physique à 1,50 m trouve ici encore sa pleine justification.
La question est de savoir si ce bio-aérosol est suffisamment chargé en agents infectieux pour contaminer un sujet traversant cette atmosphère (Xie et coll., 2007 ; Wei et coll., 2016). Ceci étant, ce mode de transmission aéroportée (bio-aérosol) avec infection du tractus respiratoire bas a été validé pour la tuberculose (Stilianakis et coll., 2010), mais aussi pour les oreillons, la varicelle, la grippe (Xu et coll, 2020).
Il est néanmoins utile de rappeler que le fluide oral entraîné par le flux d’air généré par la toux, charrie environ 100.106 micro-organismes par ml (Curtis et coll, 2011) et, plus particulièrement, de l’ordre de 105 à 108 copies d’ARN de SARS-CoV-2/ml lors de l’infection (Han et coll., 2020, To et coll., 2020). Le fluide oral contient aussi des éléments d’origine sérique via le fluide gingival et du sang apporté par des micro-hémorragies (Subbarao et coll., 2019).
La charge virale SARS-CoV-2 dans la salive est détectable, voire importante, dès les premiers jours qui suivent le début de l’infection et pourrait ensuite perdurer une dizaine, voire une vingtaine de jours (To et coll., 2020 ; Yang et coll. 2020). Cette charge semble être corrélée à la sévérité de la maladie (Fang et coll., 2020) et est non négligeable par rapport à celle du nasopharynx ou des selles (Zhang et coll., 2020 ; Williams et coll., 2020). Ceci semble pouvoir s’expliquer par la présence de nombreux récepteurs ACE2 de ce virus sur les cellules épithéliales des muqueuses orales et au niveau des glandes salivaires (Xu J et coll. 2020 ; Xu H. et coll., 2020), accréditant l’hypothèse que la muqueuse buccale et les glandes salivaires seraient un réservoir pour le coronavirus. La forte contagiosité de la Covid-19, en partie liée à la haute affinité de SARS-CoV-2 pour ses récepteurs cellulaires, nous impose de prendre en compte la problématique de la transmission aéroportée du virus et du rôle des gouttelettes ou aérosols issus de la cavité buccale.
Des données récentes nous renseignent aussi sur la situation du tractus respiratoire. Une charge virale de SARS-CoV-2 est détectée dans les parties basses et hautes de ce tractus (Wölfel et coll., 2020). Cette charge est élevée à hauteur du pharynx lors de la première semaine symptomatologique (pic à 7,11 x 108 copies d’ARN par écouvillon de prélèvement). On trouve aussi une population distincte de SARS-CoV-2 au niveau pulmonaire (Wölfel et coll., 2020).
Soulignons aussi que la très petite taille de ces gouttelettes est tout à fait compatible avec le transport d’agents infectieux (virus de 50 nm à 1 µm, SARS-CoV-2 à 125 nm, voire Mycobacteriumtuberculosis, malgré sa taille de 1 à 3 µm).
Le potentiel contaminant de ces gouttelettes chargées reste posé. La détection et le comptage des copies d’ARN de SARS-CoV-2 ne suffisent pas pour valider une possible transmission ; en effet, ce n’est pas le seul ARN qui est contaminant mais la particule virale dans son intégrité. Si les plus grosses gouttelettes encore très hydratées sont incontestablement contaminantes – les études sur la survie des virus sur les fomites en attestent –, la transmission aéroportée par les noyaux-gouttelettes très peu hydratées (< 10 µm) constituant les aérosols répandus à plusieurs mètres, pose encore problème. Il est vrai que les bio-aérosols ont déjà été impliqués dans la transmission aéroportée de certains virus comme le SARS, le MERS ou H1N1 (Stelzer-Braid et coll., 2009). La présence de SARS-Cov-2 sur des particules aéroportées est discutée dans des contextes de confinement hospitalier (Liu et coll, 2020).
Survie de SARS-CoV-2 sur les fomites
La transmission de virus à partir de surfaces sèches contaminées est avérée de longue date, y compris l’auto-inoculation des muqueuses buccales, nasales et oculaires par les mains ayant touché ces surfaces (Kampf et coll., 2020). La survie de SARS-CoV-2 sur fomite a été étudiée par projection d’une solution contenant le virus sur diverses surfaces (Van Doremalen et coll., 2020) ; à divers temps, chaque surface a été frottée à l’aide d’un coton tige qui a servi à infecter des cellules en culture (pouvoir infectieux). Le virus reste viable (et donc infectant) jusqu’à 72 h sur le plastique, mais avec une diminution du titre infectieux d’un facteur 1259 ; cette même chute du titre sera atteinte en 48 h sur un fomite acier inoxydable dans les conditions expérimentales retenues. Sur une surface de cuivre, on ne retrouve pas de SARS-CoV-2 viable après 4 h, alors qu’il faudra attendre 24 h pour obtenir le même résultat sur du carton. On peut exprimer ces résultats en demi-vie :
• 5,6 h sur l’acier
• 6,8 h sur le plastique
• 1 h sur le cuivre
• 3,2 h sur le carton
Une autre étude très récente (Chin et coll., 2020) montre que les faces interne et externe des masques de protection peuvent être contaminées pendant plusieurs jours par le virus SARS-CoV-2.
Ces résultats, qui attendent confirmation par d’autres études, renforcent la probabilité de transmission par contact avec des fomites puisque le virus peut demeurer viable et infectant plusieurs jours sur des supports (plastique, acier) très présents dans le milieu médical, mais aussi dans les transports en commun, les véhicules et nos logements…
Cheng et coll. (2016) ont étudié la transmission du virus influenza par les gouttelettes exhalées par la toux ; ils concluaient sur une probabilité de 50 % que le R0 (facteur de reproduction de contamination) dépasse 1 pour les particules très petites de 0,3-0,4 µm dans un espace confiné.
Une autre étude récente s’est aussi intéressée au potentiel infectieux du virus influenza contenu au sein des gouttelettes et bio-aérosols émis lors de la respiration (Yan et coll., 2018). Les auteurs ont comparé les comptages de copies d’ARN viral dans les écouvillons de prélèvements nasopharyngés avec les mêmes comptages dans des échantillons de respiration (< 5 µm et > 5µm). Les auteurs retrouvent des virus infectieux cultivables (influenza) dans 39% des bio-aérosols (< 5 µm) et 89 % des écouvillons de prélèvements nasopharyngés.
A notre connaissance, une seule étude a envisagé la survie de SARS-CoV-2 en bio-aérosols (van Domeralen et coll., 2020). Le SARS-CoV-2 reste viable dans les conditions de laboratoire retenues pendant les 3 heures de l’expérimentation avec une diminution du titre infectieux d’un facteur 6,31, soit une demi-vie de 1,1 h (0,64-2,64 h pour un degré de confiance de 95%).
Il est certain que si ce virus ne pouvait pas se transmettre via des bio-aérosols, il serait extrêmement difficile d’expliquer certains cas de contamination en espaces confinés (Wang et Du, 2020 ; Morawska et Cao, 2020). Mais quelle est la durée de cet éventuel pouvoir contaminant du bio-aérosol ? A ce jour, on ne le sait pas vraiment. On pourrait s’attendre à ce que plus l’atmosphère est chaude et sèche (RH bas), moins les virus auront de chance de survivre longtemps dans leurs noyaux-gouttelettes très déshydratés. Les risques de transmission aéroportée seront d’autant plus grands que l’espace chargé en bio-aérosols sera confiné. N’oublions pas que la transmission d’un agent infectieux dépend aussi de la « dose infectante » ; la dilution naturelle, les conditions d’aération, les dimensions de la pièce, l’importance de la charge virale initiale influeront sur ce paramètre « dose infectante ».
Formation des gouttelettes lors des soins bucco-dentaires
La plupart des instruments dynamiques utilisés en pratique bucco-dentaire génèrent des aérosols : turbine, détartreur ultrasonore, aéropolisseur, seringue air/eau, contre-angle. La pression et le volume d’air injecté, la quantité d’eau propulsée, la vitesse de rotation et les ultrasons vont contribuer à produire un aérosol qui va s’enrichir en débris et en fluide oral plus ou moins riche en contaminants potentiels. De nombreuses études ont démontré par le passé la contagiosité de ces aérosols induits par les activités de soins (Veena et coll, 2015 ; Harrel et coll, 1998 ; Bentley et coll, 1994). On retrouve des traces de contamination jusqu’à 3 m de la bouche du patient, traces pouvant séjourner dans l’atmosphère de la salle de soins pendant 4 heures avant de retomber sur les surfaces sous-jacentes (Rautemaa et coll, 2006 ; Harrel et coll, 1998 ; Zemouri et coll, 2017). Là encore se pose le problème de la contagiosité réelle de ces aérosols qui dépend de la viabilité du SARS-CoV-2 dans ces conditions, et de sa concentration (notion de dose infectante) dans l’air ambiant.
L’utilisation d’un bain de bouche préalablement aux soins pourrait-il réduire les risques de transmission du virus? Il n’a pas encore été scientifiquement prouvé que des bains de bouche ont un effet virucide sur le SARS-CoV-2 (Duffau et coll, 2020). Parce que SARS-CoV-2 serait sensible à l’oxydation, le peroxyde d’hydrogène à 0,5 % ou la polyvidone à 0,2 % pourrait être préconisé (ADA – Interim Guidance, 2020).
Mais n‘oublions pas que si la cavité buccale est bien un réservoir pour ce virus, il faut s’attendre à ce que le stock de SARS-CoV-2 « disponible » en bouche se renouvelle très rapidement.
De ces données, nous pouvons déduire des recommandations de bon sens :
– considérer tout patient comme potentiellement infecté ;
– utiliser en préalable un bain de bouche (H2O2, polyvidone) ;
– poser la digue chaque fois que c’est possible ;
– réduire au minimum la puissance des sprays ;
– porter masque FFP2, lunettes, visière, charlotte, surblouse pour tous les soignants de l’environnement de soins ;
– décontamination et désinfection de toutes les surfaces jusqu’à 3 m de la scène de soins ;
– aérer la salle de soins entre chaque patient.
Conclusion
Toutes ces données sur les gouttelettes et les bio-aérosols sont bien sûr à la base de toutes les recommandations sur les gestes barrière. La durée de vie des virus dans les gouttelettes, sur les fomites, mais surtout au sein des bio-aérosols (et des « noyaux » très déshydratés), est encore mal connue ; il en va bien entendu de la potentielle transmission dans les espaces fermés, les salles de soins et de consultation, les transports en commun, l’intérieur des véhicules, les logements (Wei et coll., 2016).
Le port des masques fait débat, entre pénurie, bon usage et efficacité. Les travaux sur ce sujet (non abordés dans cette revue) sont contradictoires, confondant souvent taille des particules, nombre de gouttelettes, durée de vie, dose infectante et pouvoir contaminant.
Le fameux FFP2 (ou son équivalent américain N95) retient 95% des particules jusqu’à 0,3 µm. On comprend qu’il soit utilisé par les soignants les plus exposés puisqu’il arrête bien entendu les plus grosses particules émises par le porteur mais aussi les plus fines (jusqu’à 0,3 µm) présentes dans l’air ambiant à proximité d’un sujet infecté (sous condition qu’il soit bien porté). Le masque chirurgical, lui, ne filtre qu’à 5 µm. Il retient les plus grosses gouttelettes, majoritaires en sortie de bouche et de nez, mais ne bloquera que certaines des plus fines particules en suspension dans l’air émises par des sujets infectés avoisinants ; il contribue à réduire la teneur en gouttelettes potentiellement infectantes inhalées. Quant au masque alternatif, fait maison (selon recommandations AFNOR), avec plusieurs couches de coton 120 fils, il est sensé réduire la diffusion de grosses gouttelettes par son porteur. Son rôle filtrant vis-à-vis des particules les plus fines est plus illusoire, tout juste en arrêtera-t-il une certaine proportion ; en revanche, il réduit nettement le risque de contamination par des doigts souillés portés au visage puisqu’il offre un écran entre main et proximité des muqueuses nasales et buccales (mais pas oculaires).








Commentaires